전기모세관 현상
전해질 표면이 대전되면 표면의 표면 장력은 인접한 상의 화학적 조성뿐만 아니라 전기적 특성에 따라 달라집니다. 이러한 특성은 표면 전하 밀도와 계면에서의 전위차입니다.
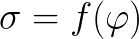
이 현상에 대한 전위차에 대한 표면 장력의 의존성(e)은 전기모세관 곡선으로 설명됩니다. 그리고 이러한 의존성이 관찰되는 바로 그 표면 현상을 전기 모세관 현상이라고 합니다.
전극 전위가 전극-전해질 인터페이스에서 어떤 식으로든 변경되도록 합니다. 이 경우 외부 EMF가 전혀 없지만 표면 전하를 형성하고 전기 이중층의 존재를 유발하는 이온이 금속 표면에 있습니다.
같은 전하를 띤 이온은 계면 표면에서 서로 반발하여 액체 분자의 수축력을 보상합니다. 결과적으로 전극에 과잉 전위가 없을 때보다 표면 장력이 낮아집니다.
반대 부호의 전하가 전극에 가해지면 이온의 상호 반발력이 감소하기 때문에 표면 장력이 증가합니다.
반발 이온의 정전기력에 의한 인력의 절대 보상의 경우 표면 장력은 최대에 도달합니다. 전하를 계속 공급하면 새로운 표면 전하가 발생하고 성장함에 따라 표면 장력이 감소합니다.
어떤 경우에는 전기 모세관 현상의 중요성이 매우 큽니다. 그들은 액체와 고체의 표면 장력을 변화시킬 수 있을 뿐만 아니라 접착, 습윤 및 분산과 같은 콜로이드 화학 공정에 영향을 줄 수 있습니다.
이 종속성의 질적 측면으로 다시 주의를 돌려보자. 열역학적으로 표면 장력은 단위 표면을 형성하는 등온 과정의 작업으로 정의됩니다.
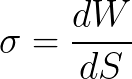
표면에 같은 이름의 전하가 있으면 정전기적으로 서로 밀어냅니다. 정전기 반발력은 표면에 접선 방향으로 향하여 어쨌든 표면적을 늘리려고 합니다. 결과적으로 대전된 표면을 늘리는 작업은 유사하지만 전기적으로 중성인 표면을 늘리는 데 필요한 작업보다 적습니다.
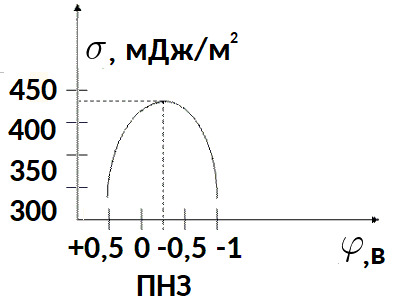
예를 들어 실온에서 전해질 수용액의 수은에 대한 전기모세관 곡선을 살펴보겠습니다.
최대 표면 장력 지점에서 전하는 0입니다. 수은 표면은 이러한 조건에서 전기적으로 중성입니다.따라서 전극 표면장력이 최대가 되는 전위가 영전하전위(ZCP)이다.
제로 전하의 전위 크기는 액체 전해질의 특성 및 용액의 화학적 조성과 관련이 있습니다. 표면 전위가 제로 전하 전위보다 작은 전기모세관 곡선의 왼쪽을 양극 가지라고 합니다. 오른쪽은 음극 분기입니다.
전위의 아주 작은 변화(약 0.1V)는 표면 장력에 눈에 띄는 변화(제곱미터당 약 10mJ)를 생성할 수 있다는 점에 유의해야 합니다.
전위에 대한 표면 장력의 의존성은 Lippmann 방정식으로 설명됩니다.
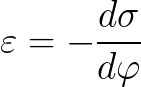
전기 모세관 현상은 금속에 다양한 코팅을 적용할 때 실용적으로 적용됩니다. 이를 통해 고체 금속이 액체에 젖는 것을 조절할 수 있습니다. Lippmann 방정식을 사용하면 전기 이중층의 표면 전하와 정전 용량을 계산할 수 있습니다.
전기 모세관 현상의 도움으로 계면 활성제의 표면 활성은 이온이 특정 흡착을 가지기 때문에 결정됩니다. 용융 금속(아연, 알루미늄, 카드뮴, 갈륨)에서 흡착 용량이 결정됩니다.
전기 모세관 이론은 폴라로그래피의 최대값을 설명합니다. 전위에 대한 전극의 습윤성, 경도 및 마찰 계수의 의존성은 또한 전기 모세관 현상을 나타냅니다.

